角膜移植术后感染性结晶状角膜病变一例
曾庆延 陆秀兰 吴尚操
感染性结晶状角膜病变( infectious crystalline keratopathy,ICK)是一种较为少见的角膜感染,1983年Gorovoy等(1)首次报道该病,Meialer等(2)在1984年命名,迄今为止全球已有70余篇相关文献,我国尚未见该病例报道。2010年武汉爱尔眼科医院诊治l例ICK患者。
患者女性,71岁,因右眼畏光、流泪十余天,于2010年2月10日入住我院。入院检查:右眼视力眼前30cm手动,左眼0.12(国际标准视力表)。右眼上、下睑数根倒睫,结膜混合性充血(+ +),中下方约1/2角膜溃疡并穿孔,大量虹膜脱出嵌顿,上方前房浅,下方前房窥不清,瞳孔区窥不清(图1)。左眼上睑数根倒睫,上睑结膜瘢痕,角膜上、下方血管翳长入,角膜中央云翳,前房清。辅助检查:右眼角膜溃疡区刮片未见真菌茵丝,革兰染色见多量中性粒细胞。B超示右眼玻璃体轻度混浊。入院诊断:(1)右眼角膜溃疡穿孔(细菌性?),(2)双眼沙眼倒睫。
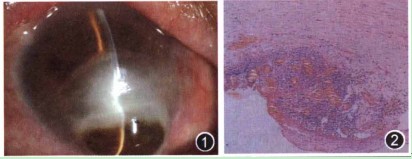

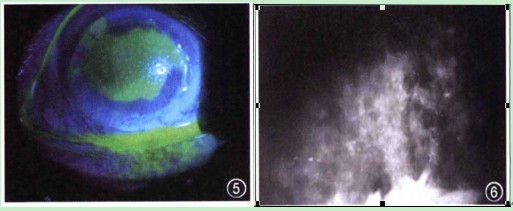
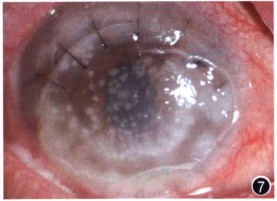
图1 入院时,裂隙灯显微镜下观察感染性结晶状角膜病变患者右眼,可见角膜中、下方约1/2溃疡并穿孔,大量虹膜脱出嵌顿,上方前方浅,下方前方窥不清,瞳孔区窥不清 图2 光镜下观察感染性结晶状角膜病变患者角膜组织,可见角膜溃破处周围上皮炎性坏死,后弹力膜消失,并见大量中性白细胞细胞侵润 HE染色*100 图3 裂隙灯显微镜下观察感染性结晶状角膜病变患者,可见右眼角膜植片多量松针状、雪花状混浊,边界清晰,混浊之间角膜透明,基质无明显浸润,前房房闪(+),下方线状积脓 图4 裂隙灯显微镜下观察感染性结晶角膜病变患者可见有雪花状混浊位于角膜上皮下潜基质层,其下基质透明,无明显水肿浸润 图5 裂隙灯显微镜下观察感染性结晶状角膜病变患者荧光素染色,可见角膜混浊相应区域上皮大面积缺损 图6 共焦显微镜下观察感染性结晶状角膜病变患者右眼,可见角膜基质层反射不均匀,部分基质层反射增强*40 图7 裂隙灯显微镜下观察感染性结晶状角膜病变患者右眼,可见角膜植片上皮缺损范围扩大,累及颞上方植床;雪花状混浊边界变模糊,下方成片状融合并形成溃疡,10至12点方向植床浸润,前方下方可见线状积脓,较前明显。#p#副标题#e#
入院当日下午,在球后阻滞麻醉下行右眼穿透性角膜移植术,手术顺利。术中取下角膜片的1/3份送病理检查,示角膜溃破处同围上皮炎性坏死,后弹力膜消失,并见大量中性白细胞细胞浸润,过碘酸-希夫(periodic acid-schiff,PAS)染色(-),未见真菌苗丝(图2);1/3份送真菌培养,1/3份送细菌培养,培养结果均为阴性。术后常规给予抗炎、抗细菌治疗(复方妥布霉素滴眼液4次/d,0.5%左氧氟沙星滴眼液4次ld,0.3%氧氟沙星眼膏每晚1次,复方托吡卡胺滴眼液活动瞳孔)。患者病情稳定,恢复良好。于术后l周出院。
术后1个月复查,患者自觉眼部无不适,眼部检查:右眼视力0.15,眼压12 mm Hg(l mm Hg =0.133 kPa)。角膜程片透明,七皮完整光滑,前房清,虹膜周切口通畅,瞳孔类圆晶状体混浊,眼底视网膜在位。继续常规抗炎治疗:复方要布霉素滴眼液4次/d,l%环孢素A眼液4次ld,0.l%玻率酸钠滴眼液4次ld。
2010年4月15日,患者复诊,自诉眼部异物感5d,无明显红痛不适。眼部检查:右眼视力0.1,结膜混合充血(+),角膜植片大片上皮缺损,上皮缺损区可见多量松针状、雪在状浅基质混浊,无明显浸润,混浊基质之间的角膜透明,缝线在位。前房浅,前房闪辉(+),下方线状积脓,晶状体混浊.眼底窥不入(图3~5)。眼压:右眼13.O mm Hg,左眼18.3 mm Hg。辅助检查:右眼角膜混浊区刮片未见真菌菌丝,革兰染色未见明显细菌及中性粒细胞。角膜混浊区取材送细菌培养。共焦显微镜检查右眼角膜基质层反射不均匀,部分基质层反射增强(图6)。给予0. 5%左氧氟沙星眼液4次/d滴眼,停用复方妥布霉素滴眼液。
2010年4月19日角膜取材培养结果显示草绿色链球菌感染,对以下药物敏感:氯霉素、克林霉素、红霉素、氧氖沙星、青霉素、万古霉素。因复查角膜病灶无明显变化,遂收治入院。入院诊断:(1)右眼感染性结晶状角膜病变,(2)右眼穿透性角膜移植术后。人院后给予强化抗细菌治疗:0.5%左氧氟沙星滴眼液每30分钟1次,5%万古霉素滴眼液每30分钟1次,0. 3%氧氟沙星眼膏每晚1次,头孢哌酮3.0 g全身静滴1次ld。
2010年4月23日,眼部检查:右眼视力眼前指数,结膜混合性充血(+ +),角膜植片大片上皮缺损,雪花状混浊边界变模糊,下方成片状融合溃疡形成,累及植床,10至12点方向植床浸润,前房欠清,下方可见线状积脓(图7)。建议患者行二次角膜移植术,患者及其家属要求保守治疗,带药出院。
讨论ICK是一种特殊类型的角膜感染,其特点是出现在角膜基质层的灰白色圆形、分支状、雪花状或松针样的混浊,病变区往往上皮缺损,但基质无明显炎症反应[1-2]。多发生于角膜移植术后[1-3],亦有报道见于准分子激光原位角膜磨镶术(laser-assisted in situ keratomileusis.LASIK)、白内障等与角膜相关手术后,患者多有术后长期使用糖皮质激素病史,此外既往有病毒性角膜炎、棘阿米巴角膜炎、眼类天疱疮病吏患者以及长期使用眼表麻醉剂患者亦有发生ICK报道(4-5)。
引起ICK的病原体多为低致病力细菌,以革兰阳性球菌中草绿色链球菌最为常见(6),其次有肺炎链球菌、溶血双球菌、兼性双球菌及表皮葡萄球菌等;革兰阴性杆菌中产气肠杆菌、铜绿假单胞菌、不动杆菌、克氏柠檬酸杆菌也可在某些情况下引起ICK,临床表现与革兰阳性菌所致者无差别(7);非结核性分枝杆菌多见于LASIK术后(4)。此外真菌中念珠菌属、链格孢属以及包柔螺旋体均曾在ICK病变角膜组织中被分离检出。
ICK发病机制尚不完全明确。通常认为免疫抑制、神经营养不良及生物膜形成在此病变过程中扮演重要作用。已有多量研究证实在病变角膜组织板层间检出病原体菌落,染色可发现菌落外生物膜包裹,角膜板层结构基本正常,无中性粒细胞浸润(8-9)。推断由于糖皮质激素的长期使用,或者由于角膜正常神经的缺乏(角膜移植术后或角膜炎症反应后),机体不能对外来病原体产生正常的炎症反应,使得病原体得以经缺损角膜上皮或线道入侵到基质,形成广泛的生物膜样结构,生物膜的形成可使病原体进一步逃避机体免疫监视,并使药物难以到达病原体,从而造成体外药敏试验病原体对多数药物敏感,而在体内往往药韧治疗收效甚微。本文病例为老年患者,身体瘦弱,角膜移植术后有较长期(2个月)使用糖皮质激素滴眼液病史,推测其ICK的发生与其自身免疫力低下、角膜移植术后植片神经缺乏及糖皮质激素抑制机体正常炎症反应有关。患者给予强化抗细菌治疗并停用糖皮质激素后逐渐出现角膜病灶融合浸润及前房炎症反应加重情形,亦说明糖皮质激素的免疫抑制作用是本病变特征性改变出现的重要因素之一。
综上所述,ICK的诊断主要依据如下:(l)病史:术后(尤其是角膜移植术后)、长期使用糖皮质激素、神经营养不良等;(2)临床特点:角膜基质层的灰白色圆形、分支状、松针样或雪花状混浊,基质、前房无明显炎症反应,对抗菌药物不敏感;(3)实验室检查:病灶刮片培养可检出革兰阳性、G-菌、真菌等,多为低致病力菌种;(4)特殊检查:酶联免疫吸附法、电镜检查可进一步分离病原体,明确诊断。
对ICK治疗常规药物治疗往往效果不佳,因为滴眼时药物难以突破病原体外生物膜到达病菌。仅少数报道通过强化抗菌药物治疗控制感染(10),多数病例需联合手术治疗。手术治疗方案包括病灶浅层切除联合基质内注入敏感抗茵药物(11)、板层或穿透性角膜移植手术(8-9),LASIK术后患耆多需去除受累角膜瓣后继续抗菌治疗(4)。该患者即对全身及局部强化抗细菌治疗均不敏感,遗憾的是该患者因经济原因未接受再次角膜移植手术,使我们缺乏对其病变治疗效果以及病理学改变的全面认识。此外,激光也被尝试用于治疗ICK,但其不足之处为术后会改变患者屈光状态。近年,陆续有研究用Nd: YAG激光治疗ICK(12),效果良好,其原理为破坏菌落外生物膜,使药物得以渗透杀死病原体。相信随着对ICK发病机制认识的不断加深,会有更多的措施以预防和治疗该疾病。
参考文献
[1] Gorovoy Ms. Stem CA. Hood a, et al. Intrastromal noninflammatory bacterial colonization a corneal graft Arch Ophthalmol. 1983 . 101 : 1749-1752.
[2] Meisler Dtd. Langston RH. Naab TJ.d al. Infectioua crystalline keratopathy. Am J Ophthalmol.1984,97 : 337-343.
[3] Dunn S. Magnen E, Rao NA. No inflammatory bacterial infiltration of a comical graft. Cornea.1985 .86 : 189-193.
[4] Alvarenga L. Fmitas D. Hofling-Iima AL. et aL InfectiooD poat-LASIK crystalline keratopathy caured by nontuberculou!
mycobacterium. Comea , 2002 ,21 :426 429 .
[5] Supine JL, Kantor AL, Mathen} WD, et al. Evaluation of infectious crystalline katydid with confuse micro. copy in a cue series. Comea,1997 , 16 :21-26.
[6] Kaufmann JG, Driebe W, Margo CE. Stteptococcr18 viridtuu-induced coastline keratopathy and funSal keratitin. Am J Ophthalmic, 1992 , 114 :97-99.
[7] Khater lT, Jonea DB, Wilheluma KR. Infection crystalline keratopathy cauaed by fVam negative bacteria. Am J Ophthalmic,1997 , 124 :19-23.
[8] Elder MJ, Matheson M, Stapleton F, et al. Befoul connation in infectious cry8talline keratopathy due to Candida abdicant. Come, 1996 ,15 : 301-304.
[9] Fulcher TP, Dart JK, McLauShlin-Borlace L, et al.Demomtration of biofilm in infectious crystalline keratopathy using ruthenium red and electron microscopy. Ophthalmology, 2001,108 : 1088-1092.
[10] EIMallah MK, Munir WM, Janda WM, et al. Gamelan haemolyaana infectious crystalline keratopathy. Comes, 2006 ,25 : 1245 -1247.
[11] Khan U, Hamada S, Rauz S. Infectioua cryatalline keratopathy treated with intrastrorMl antibiotic. Comea, 2010, 29, 1186-1188.
[12] Daneshvar H, Maclnnis B, Hodge WG. Nd:YAG laser comeal disruption as adjuvant treatment for infectious cnrstalline keratopathy. Am J Ophthalmol, 2000 , 129 :800-801.



